Die neue Fälschungsrichtlinie 2019 – welche Arzneimittel sind betroffen?

Seit Februar 2019 ist es soweit und die Fälschungsschutzrichtlinie (2011/62/EU), die 2011 verabschiedet wurde, trat offiziell in Kraft. Was bedeutet das für die betroffenen Akteure wie Pharmahändler, Apotheken und pharmazeutische Unternehmen?
Hintergrund
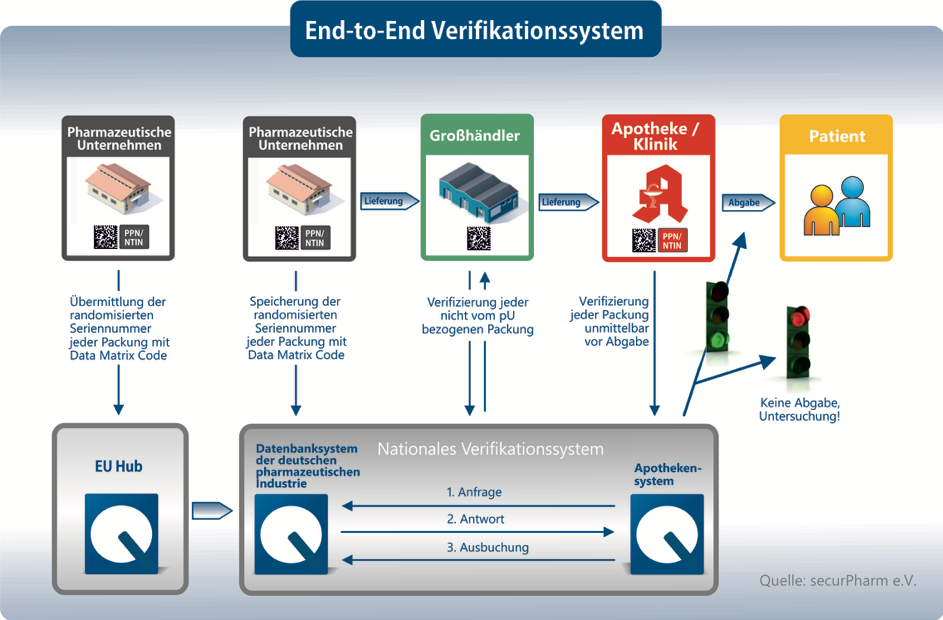
Zum Schutz vor Arzneimittel-Fälschungen, die von niedriger Qualität oder falsch dosiert sein können, wurde im Rahmen der Fälschungsschutzrichtlinie ein End-to-End-Überprüfungssystem in der EU eingeführt. Dieses Überprüfungssystem sieht eine Authentifizierung von Arzneimitteln vor, die durch verbindliche Sicherheitsmerkmale auf den Verpackungen und ein übergreifendes europaweites Datenbanksystem ermöglicht wird. Mit den Maßnahmen der Fälschungsschutzrichtlinie wird der Vertriebsweg von Arzneimitteln zukünftig also noch sicherer.
Seit dem 9. Februar 2019 wird ein individuelles Erkennungsmerkmal sowie ein Erstöffnungsschutz für jedes verifizierungspflichtige Arzneimittel obligatorisch, um für den Verkehr freigegeben zu werden. Wurden Arzneimittel bereits vor dem 9. Februar für das Inverkehrbringen freigegeben, dürfen sie bis zum Ende ihrer Verfalllaufzeit auch ohne Sicherheitsmerkmale abgegeben werden. Das könnte wiederum dazu führen, dass ein Medikament in drei verschiedenen Ausprägungen am Markt verfügbar ist: einmal ohne Sicherheitsmerkmal, einmal mit Sicherheitsmerkmal, aber ohne Erfassung in der Datenbank, und einmal mit Sicherheitsmerkmal und in der Datenbank erfasst.
Welche Maßnahmen enthält die Richtlinie?
Für die erfolgreiche Bekämpfung von Arzneimittelfälschungen werden durch das Inkrafttreten der Fälschungsschutzrichtlinie europaweite Maßnahmen losgetreten. Mit den äußeren Merkmalen der Arzneimittel gehen zudem strengere Vorschriften für die Einfuhr von Arzneimittelwirkstoffen und die Dokumentation für Großhändler einher. Um die Echtheit des Arzneimittels feststellen zu können wurden insgesamt zwei Sicherheitsmerkmale festgelegt, die vor der Abgabe überprüft werden müssen.
1. Individuelles Erkennungsmerkmal
Jede Arzneimittelpackung wird mit einem individuellen Erkennungsmerkmal ausgestattet, das in einem zweidimensionalen Data Matrix Code abgebildet ist. Der Data Matrix Code setzt sich aus der Seriennummer, einem Produktcode, einer Kostenerstattungs- und Identifikationsnummer, der Chargennummer und dem Verfalldatum zusammen. Damit wird jede Packung zu einem Unikat, das über den Produktcode eindeutig identifizierbar ist. Wird der Code auf der Verpackung gescannt kann anhand des Abgleichs mit dem Datenbanksystem Rückmeldung darüber gegeben werden, ob der Data Matrix Code tatsächlich existiert und wie der Status der Packung ist. Kann der Code nicht im System gefunden werden oder ist vermerkt, dass diese Packung bereits abgegeben wurde, kann es sich um ein gefälschtes Arzneimittel handeln.
2. Erstöffnungsschutz
Neben dem Erkennungsmerkmal müssen die betroffenen Arzneimittel zukünftig zudem mit einer Vorrichtung gegen Manipulation versehen sein. Der Erstöffnungsschutz dient dazu, zu überprüfen, ob die äußere Verpackung des Arzneimittels bereits geöffnet wurde. Wie dieser Erstöffnungsschutz genau aussieht, ist dem pharmazeutischen Unternehmen dabei selbst überlassen. Mithilfe der Sicherheitsmerkmale und dem End-to-End-Überprüfungssystem kann am Ende der Lieferkette, vor allem also in Apotheken und Kliniken, systematisch überprüft werden, ob es sich um ein gefälschtes Arzneimittel handelt.
Wer ist von der Richtlinie betroffen?
Von der Fälschungsschutzrichtlinie sind alle Akteure der Lieferkette betroffen. Jedem dieser Akteure kommen dabei Aufgabe zu, die er ab der Einführung der Richtlinie im Februar zu erfüllen hat.
Welche Arzneimittel sind von der EU-Fälschungsrichtlinie betroffen?
Welche Arzneimittel fallen unter die Fälschungsrichtlinie?
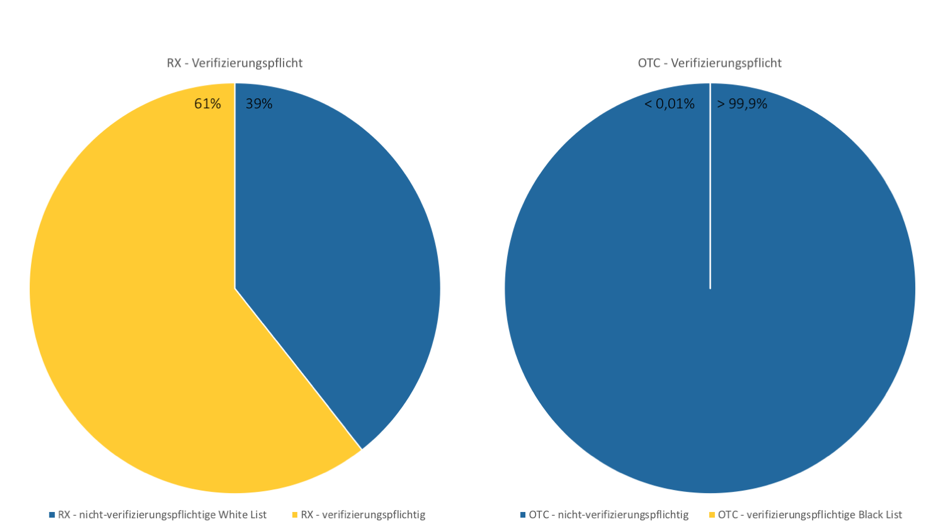
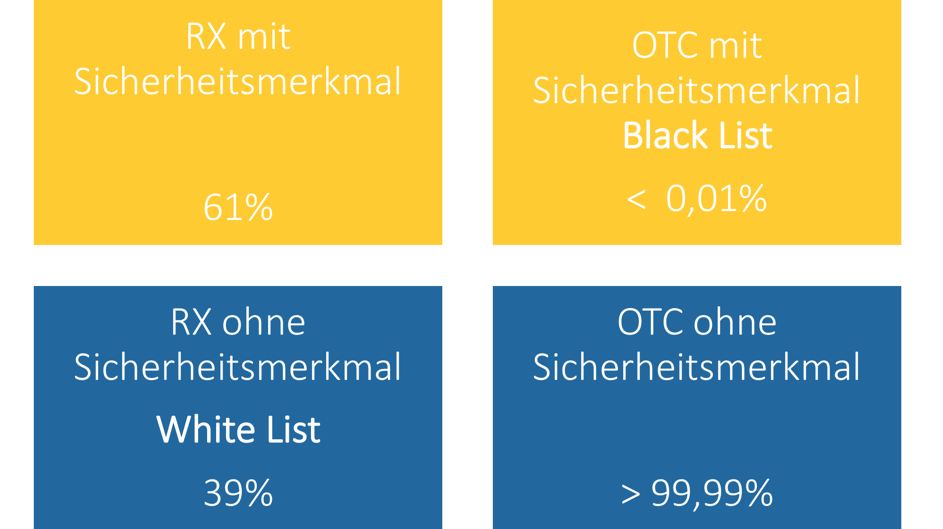
Welche Arzneimittel jetzt verifizierungspflichtig sind und warum finden Sie als lizenzierter Nutzer ab sofort tagesaktuell im ABDA-Artikelstamm von pharmazie.com. Hier stellen wir Ihnen ein kleines Widget zur Verfügung, mit dem Sie (auch ohne Anmeldung) einen kleinen Blick in unseren ABDA-Artikelstamm werfen können. Tragen Sie hier eine gültige Pharmazentralnummer (PZN) ein, und Sie erhalten die tagesaktuelle Auswertung direkt angezeigt.
Woran erkenne ich ein verifizierungspflichtiges Arzneimittel?
Wichtig für Pharmazeutische Firmen, Pharmagroßhandlungen, Parallelhändler und Apotheken: Die EU-Mitgliedsstaaten können die Verifizierungspflicht in Form des individuellen Erkennungsmerkmals und des Erstöffnungsschutz auf weitere Arzneimittel ausdehnen. Die Liste der verifizierungspflichtigen Arzneimittel kann also laufend aktualisiert werden. Der ABDA-Artikelstamm in pharmazie.com wird deshalb regelmäßig um entsprechende Informationen erweitert. Dazu zählen nicht nur betroffenen Arzneimittel, sondern auch technische Details der Sicherheitsmerkmale, Modalitäten der Überprüfung und die Verwaltung des Datensystems. Sobald das passiert, bekommen Sie über pharamazie.com Bescheid und werden über alle wichtigen Aktualisierungen informiert – damit sind Sie immer auf dem neuesten Stand!
Bei all diesen neuen Regelungen und Prozessen gilt es, den Überblick zu behalten: pharmazie.com hat alle wichtigen Informationen zur neuen Fälschungsschutzrichtlinie für Sie zusammengefasst. Hier finden Sie auch die aktuelle Liste der von der Fälschungsschutzrichtlinie betroffenen, verifizierungspflichtigen Arzneimittel.
Download Excel Datei
mit ca. 58,000 Pharmazentralnummern (PZN, Name, Darreichungsform, Anbieter und Verifizierungspflicht):
Ähnliche Beiträge
Das neue Verpackungsgesetz 2019 – wer ist betroffen?
BtM Medikamenten Liste – welche Arzneimittel gelten als Betäubungsmittel?
BtM Medikamenten Liste – welche Arzneimittel und Substanzen zählen als Betäubungsmittel?Aufgrund ihres Abhängigkeits-, Missbrauchs- und Nebenwirkungspotentials wird eine Gruppe zentral wirksamer Arzneimittel – sogenannte Betäubungsmittel (BtM) – in Deutschland stark...
IFA Arzneimittel und ihr Weg in Arzneimitteldatenbanken
IFA Arzneimittel und ihr Weg in die ArzneimitteldatenbankenWie gelangen die IFA Arzneimittel Informationen über den ABDA-Artikelstamm bis zu Arzneimitteldatenbanken wie pharmazie.com? Diese Frage beantwortet der folgende Beitrag. Sie erfahren, wer die IFA ist, für was...